Vanessa Jacobs, Fernanda Siqueira Souza*, Janice Botelho Souza Hamm, Fabiana Szczesny Mancilha
Universidade La Salle, Canoas, Rio Grande do Sul. Correo electrónico: fernanda.souza@unilasalle.edu.br
Enviado: Febrero 2019; Aceptado: Abril 2020
Texto completo (pdf)
Cita (APA)
Jacobs, V., Siqueira Souza*, F., Souza Hamm, J. B., Szczesny Mancilha, F., (2020). Produção e caracterização de biofilmes de amido incorporados com polpa de acerola. Revista Iberoamericana de Polímeros, 21(3), 107-119.
RESUMO
O amido é uma ótima matéria–prima para obtenção de filmes biodegradáveis, podendo ter suas propriedades melhoradas com aditivos naturais como, por exemplo, a acerola. Nesse contexto, este projeto tem a finalidade de produzir biofilmes biodegradáveis de amido de mandioca e com adição de polpa de acerola, visando avaliar os efeitos desta incorporação por meio de caracterização dos biofilmes. Para o preparo dos biofilmes foi utilizado amido de mandioca, glicerol, e polpa de acerola. Um biofilme sem adição de acerola foi sintetizado para controle e foram produzidos filmes com adições de 10, 20, 30, 40, e 50% de acerola. Os biopolímeros produzidos foram caracterizados por sua espessura, solubilidade em água, Microscopia Eletrônica de Varredura (MEV) e posteriormente aplicados em peras para avaliação visual da sua capacidade antioxidante. Pela análise dos resultados obtidos através das técnicas de caracterização, foi possível constatar que o biofilme apresentou um aumento gradativo na espessura conforme a adição de acerola de 0,30 mm (filme sem acerola) a 0,37 mm (filme com 50% de acerola) e apresentou uma redução na solubilidade de 30% (filme sem acerola) a 24% (filme com 50% de acerola). A incorporação da polpa de acerola aos biofilmes promoveu uma melhoria em suas características.
ABSTRACT
Starch is a great raw material for biodegradable films and can be enhanced with natural additives, for example, acerola. In this context, this project aims to produce cassava starch biodegradable biofilms with the addition of acerola pulp, aiming to evaluate the effects of this incorporation by characterizing the biofilms. For the preparation of biofilms, cassava starch, glycerol and acerola pulp were used. A biofilm without acerola was synthesized for control and films were produced with additions of 10, 20, 30, 40, and 50% acerola. The biopolymers produced were characterized by their thickness, water solubility, Scanning Electron Microscopy (SEM) and subsequently applied to pears for visual evaluation of their antioxidant capacity. From the analysis of the results obtained through the characterization techniques, it was possible to verify that the biofilm presented a gradual increase in the thickness as the addition of 0.30mm acerola (film without acerola) to 0.37 mm (50% acerola film) and showed a reduction in solubility from 30% (non–acerola film) to 24% (50% acerola film). The incorporation of acerola pulp into biofilms promoted an improvement in its characteristics.
INTRODUÇÃO
O uso extensivo de plásticos (polímeros) no mundo vem sendo tema de grande debate devido a seu impacto ambiental [1]. O plástico convencional é oriundo da nafta um derivado do petróleo que consiste em um material altamente resistente e que leva no mínimo dois séculos para se decompor, sendo responsável por grande parte de resíduos que se acumulam na natureza, com consequência direta na poluição ambiental [2].
Plásticos de base petroquímica, no entanto, têm propriedades físicas de excelência que resultaram em sua ampla aplicação em quase todos os setores industriais [3]. Desta forma, estudos vêm sendo realizados visando desenvolver alternativas para a obtenção de plásticos com propriedades biodegradáveis, e que possuam as propriedades desejáveis do plástico sintético [4], [5].
Uma das alternativas para o controle da produção de plástico sintético é a obtenção de plásticos biodegradáveis, com o uso de matérias–primas de fontes renováveis, nas quais utilizam celulose, cana de açúcar, amido, entre outros. A biodegradação desse material é possível, devido à ação de microrganismos de ocorrência natural como bactérias, fungos e algas podendo ser consumidos em semanas ou meses sob condições favoráveis de biodegradação [6].
O amido é um polissacarídeo que está presente em grande quantidade nos vegetais, tais como, tubérculo, raízes e cereais, sendo uma das matérias primas mais promissoras para a produção de polímeros biodegradáveis, devido ao seu baixo custo e sua abundância, e que pode ser processado como um material termoplástico na presença de plastificantes e sob ação de calor [7]. Além disso, está estruturado na forma de grânulos, o que confere certo grau de organização para sua molécula, deixando–o com um caráter parcialmente cristalino.
A estrutura molecular do amido é formada por dois diferentes tipos de polímeros de glicose: a amilose e a amilopectina. A forma em que a amilose e a amilopectina estão dispostas nos grânulos, tem como consequência a formação de regiões mais ou menos densas. A região onde se concentra a amilopectina é mais densa ou cristalina, onde sua parte linear é responsável pela origem desta cristalinidade. As áreas amorfas são formadas por cadeias de amilose e ramificações da amilopectina [1].
A aplicação do amido na produção de filmes se baseia nas propriedades químicas, físicas e funcionais da amilose para formar géis e na sua capacidade para formar filmes [8].
Para a formação de um material termoplástico, é necessário que haja a destruição da organização dos grânulos de amido que pode ocorrer através de dois processos: gelatinização e fusão. A fusão, acontece quando o amido é aquecido com pequenas quantidades de água, necessitando de temperaturas maiores para que ocorra.
A gelatinização é a transformação irreversível do amido granular em uma pasta viscoelástica, ocorrendo na presença de excesso de água e leva a destruição da cristalinidade e da ordem molecular do grânulo através do rompimento das ligações de hidrogênio que, inicialmente mantinham a integridade deste [8].
Para obter um polímero de maior processabilidade e flexibilidade, utiliza–se plastificantes, que são substâncias que modificam as propriedades de um material polimérico, tais como flexibilidade, processabilidade, fluidez, entre outros [9]. Esses devem ser compatíveis com o biofilme, sendo mais empregado os poliois, como o glicerol e o sorbitol.
O biofilme de amido pode ser utilizado como embalagens para alimentos e para aumentar sua funcionalidade, aditivos podem ser incorporados a matriz polimérica, visando a interação com o alimento, prolongando sua vida de prateleira ou conferindo características sensoriais e/ou nutricionais desejáveis [10]. Essas embalagens são conhecidas como embalagens ativas.
As embalagens ativas que exercem efeito antioxidante são consideradas as mais importantes para a indústria [11]. A oxidação é uma das reações de degradação mais importantes que ocorrem nos alimentos, limitando a conservação deles [12].
A acerola é um fruto que contém elevados teores de antioxidantes, como vitamina C (ácido ascórbico), carotenoides e compostos fenólicos, podendo ser incorporados a biofilmes como compostos ativos. Além disso, possui em sua estrutura quantidades significativas de fibras, especialmente pectina, amido e derivados de celulose podendo, dessa forma, contribuir simultaneamente como aditivo para reforço mecânico e térmico, melhorando a barreira à água dos biofilmes [13].
Melo et al. [14], apresentaram um estudo relatando a potente atividade oxidante da acerola, caracterizando o fruto como boa fonte de compostos bioativos. Sousa et al. [13] estudaram resíduos de polpas de acerola, e destacaram essa como fonte potencial de ácido ascórbico, carotenoides totais e de fenólicos totais. Nesse contexto, o presente trabalho tem como objetivo produzir biofilme de amido, incorporado com polpa de acerola, visando avaliar os efeitos dessa adição na matriz filmogênica, através da caracterização dos biofilmes formados e avaliar qualitativamente o efeito antioxidante dos biopolímeros, por meio da aplicação em frutas.
MATERIAIS E MÉTODOS
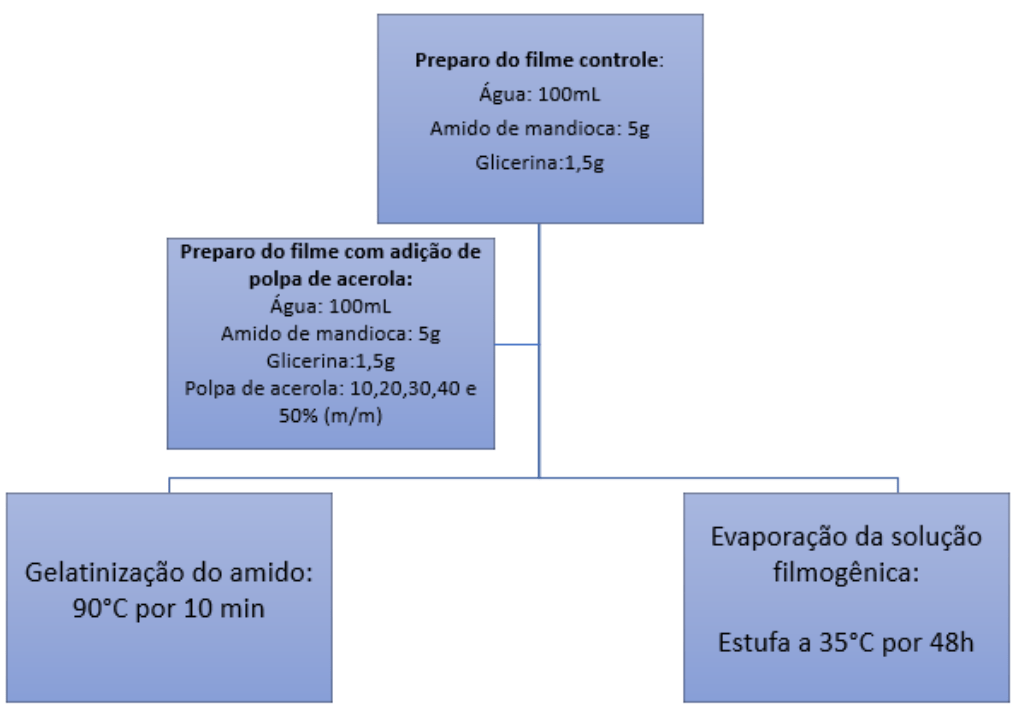
O presente trabalho foi desenvolvido no Laboratório de Química da Universidade La Salle. Para a produção do biofilme foi utilizado fécula de mandioca da marca Foco Alternativo, glicerina PA marca Nuclear, polpa de acerola congelada da marca TAEQ e água destilada. Os equipamentos e vidrarias utilizados foram: balança analítica marca Bioscale, modelo YP B20002, placa aquecedora com agitador magnético marca Multitec, estufa de incubação marca De Leo, copo de Becker, bastão de vidro e placas de poliestireno. O desenvolvimento da pesquisa foi dividido em quatro etapas: (i) preparo do biofilme de amido de mandioca; (ii) preparo do biofilme de amido de mandioca incorporado de polpa de acerola; (iii) caracterização dos biofilmes obtidos; e (v) aplicação dos biofilmes como revestimento em frutas.
Preparos dos biofilmes. Para efeito de controle, primeiramente foi elaborado um biofilme sem adição de polpa de acerola (FC). Os reagentes utilizados na síntese foram: amido de mandioca, glicerina e água destilada. As proporções utilizadas estão descritas na Tabela 1. Para a formação do biofilme seguiu–se como proposta a metodologia de Fakaouri et al. [15]. Para tal, o amido e o glicerol foram previamente pesados em balança analítica, colocados em um copo Becker juntamente com a água destilada. O copo foi levado para aquecimento em chapa aquecedora com agitação constante e aquecido até uma temperatura de 90°C por 10 min, para garantir a total gelatinização do amido. Após, a solução filmogênica formada, foi disposta em placas de poliestireno e colocada em estufa na temperatura de 35°C para que ocorresse a secagem por evaporação, técnica denominada casting.
| Ingrediente | Quantidade |
| Água destilada | 100 mL |
| Amido de mandioca | 5 g |
| Glicerol | 1,5 g |
A partir deste procedimento, novos filmes foram sintetizados com a adição de polpa de acerola com concentrações de 10, 20, 30, 40, e 50% em relação a massa do amido (F10, F20, F30, F40 e F50), de acordo com a proposta de Dantas et al. [11], com algumas modificações nas concentrações de acerola utilizada. A Figura 1 ilustra as etapas para a obtenção dos biofilmes.
Caracterização dos Biofilmes. Análise Qualitativa. Na análise qualitativa avaliou–se os biofilmes quanto a sua aparência através de observações táteis e visuais. O biopolímero deve apresentar uma superfície homogênea e contínua, sendo assim, excluíram–se das análises os filmes defeituosos, que apresentaram bolhas e fissuras após o processo de secagem [16, 17].
Espessura. A espessura é um parâmetro importante uma vez que avalia a uniformidade do material, a repetibilidade da medida de suas propriedades e a validade das comparações entre os filmes.
A espessura dos biofilmes foi medida com o auxílio de um micrômetro da marca DIGIMESS com escala de 0 a 0,25 mm com precisão de 0,001 mm. A espessura final deste correspondeu à média aritmética de cinco pontos aleatórios de cada amostra [18].
Solubilidade em água. A determinação da hidrossolubilidade dos polímeros foi realizada em duplicata, conforme metodologia descrita por Silva [1]. Assim, colocou–se uma secção do biofilme referente a 4 cm² em estufa de marca QUIMIS, a 105°C por 24 horas, em seguida, pesou–se a amostra (mi). Após o biofilme foi colocado em um Becker com 80 mL de água, em temperatura ambiente, e deixado em repouso por 24 h. Transcorrido este período o biofilme foi colocado novamente em estufa a 105°C, por 24 h. Pesou–se a amostra para obtenção da massa final (mf).
Essa técnica permitiu a determinação da perda de massa (pm) do material por solubilização através da Equação 1.
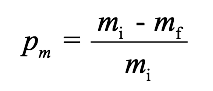
Onde,
pm = perda de massa.
mi = massa inicial obtida na primeira pesagem.
mf = massa final.
Microscopia Eletrônica de Varredura (MEV). A análise de microscopia eletrônica de varredura (MEV) foi realizada na Central Analítica do Programa de Pós–Graduação em Engenharia Química (DEQUI) da UFRGS. Utilizou–se um microscópico eletrônico de varredura Phenom World PRO X (Phenom World– Holanda). Foram utilizados álcool isopropílico PA–ACS e n-hexano PA–ACS para realizar a secagem das amostras pela técnica de troca de solventes.
As amostras foram imersas em álcool isopropílico por dez minutos, após elas foram imersas em hexano por mais 10 min e então foram acondicionadas em dessecador. Antes da análise de microscopia, as membranas secas foram fraturadas em nitrogênio líquido e recobertas com ouro.
Aplicação dos biofilmes como revestimento em frutas. Com o objetivo de avaliar qualitativamente as propriedades antioxidantes dos biofilmes de acerola, novos filmes foram produzidos para aplicação em frutas. As formulações escolhidas para o experimento foram aquelas que passaram por todas as caracterizações propostas neste trabalho. Para tal, preparou–se uma solução filmogênica sem adição de acerola, para controle, filme FC, e soluções com adição de acerola nas concentrações de 20 e 40%, filmes F20 e F40, respectivamente. As amostras foram mergulhadas nessas soluções e suspensas para posterior secagem [1]. O procedimento foi realizado em duplicata em temperatura ambiente e as amostras foram fotografadas e pesadas em balança para alimentos da marca SF–400 a cada 5 dias para avaliação do seu o aspecto visual e da perda de massa dos frutos. A porcentagem de perda de massa nos frutos foi analisada através da diferença da massa inicial e a massa final obtida.
As frutas escolhidas para o recobrimento foram peras, tendo em vista o fato de ser uma fruta climatérica, com o tempo de vida muito pequeno [19]. Uma pera sem adição de biofilme e nas mesmas condições de maturação e temperatura, também foi avaliada para efeito comparativo.
RESULTADOS E DISCUSSÃO
Análise qualitativa. Os biopolímeros sintetizados apresentaram bom aspecto visual, transparência homogeneidade e flexibilidade, exceto pelo filme F10 (10% de polpa de acerola), que se apresentou pegajoso e úmido. Provavelmente houve algum erro na formulação que interferiu no tempo de secagem deste, portanto o filme F10 foi excluído das análises. Os demais biofilmes foram facilmente removidos das placas de poliestireno. A adição da polpa de acerola causou um amarelamento dos filmes, proporcional a concentração incorporada, conforme mostra a Figura 2.

De acordo com a Figura 2, o filme controle FC (sem adição de acerola – Figura 2a), apresentou–se mais maleável que os demais biofilmes produzidos. Notou–se que quanto maior a concentração de acerola incorporada, maior a homogeneidade, a resistência e comportamento tátil. Essa percepção provavelmente está relacionada ao fato de a acerola conter em sua estrutura fibras, especialmente a pectina, amido e derivados da celulose que podem contribuir como reforço mecânico para os biofilmes [1].
Farias [20], apresentou um estudo sobre a elaboração de filmes de amido com adição de polpa de acerola e constatou que a melhor formulação para os biofilmes produzidos em seu trabalho foi o biofilme contendo amido de mandioca (70%), polpa de acerola (15%) e glicerol (15%), originando filmes com melhor aspecto visual, melhor comportamento tátil e mecânico.
Espessura. Os valores médios (± desvio padrão) de espessuras de cada biofilme estão descritos na Tabela 2.
| Biofilmes | Espessura (mm) |
| FC | 0,30 ± 0,0185 |
| F20. | 0,33 ± 0,0105 |
| F30. | 0,34 ± 0,0332 |
| F40. | 0,36 ± 0,0426 |
| F50. | 0,37 ± 0,0388 |
Com os valores obtidos, pode–se afirmar que os resultados foram satisfatórios, pois apresentaram pouca alteração em sua superfície, demonstrando a homogeneidade dos filmes formados. Segundo Silva et al. [21], biofilmes que apresentam espessura variada em um mesmo lote, podem comprometer o desempenho funcional da embalagem.
A incorporação da polpa de acerola ocasionou um aumento gradativo na espessura dos filmes F20, F30, F40 e F50 (com adição de 20 a 50% (m/m)). A dispersão uniforme destes aditivos na interface da matriz resulta em mudanças na mobilidade molecular, na relaxação e, consequentemente, nas propriedades mecânicas, com um consequente aumento de espessura [13].
Silva et al. [21], desenvolveram biofilmes de fécula de mandioca incorporados com cafeína irradiada, onde apresentaram resultados de espessura entre 0,1783 a 0,2034 mm. Os biofilmes produzidos por Farias [20], com concentrações fixas de amido de mandioca (4%), polpa de acerola (34,54%), resultaram em uma espessura de 0,377 mm, valor mais próximo ao encontrado no presente trabalho.
Solubilidade em água. Os resultados de solubilidade dos biofilmes estão descritos na Tabela 3.
| Biofilmes | Solubilidade (%) |
| FC | 35 |
| F20 | 29 |
| F30 | 29 |
| F40 | 26 |
| F50 | 24 |
Os resultados obtidos demonstram que a incorporação de polpa de acerola influenciou na solubilidade dos biofilmes produzidos. A maior solubilidade em água do filme controle (FC), composto apenas de amido, glicerol e água, pode ser justificada pelo fato do amido ser um polissacarídeo altamente higroscópico, se desintegrando rapidamente em água [22].
Segundo Pessanha [23], um material menos solúvel pode ser utilizado como embalagem em uma maior gama de alimentos, portanto, a diminuição da solubilidade em água dos filmes com adição de acerola é um fator positivo.
Farias et al. [20], relataram em seus estudos para filmes de amido de mandioca e polpa de acerola com concentrações de 34,0 a 85,4% (p/p) que a solubilidade diminui conforme o aumento da concentração da polpa. Para o biofilme com 34,0% de acerola foi encontrado uma solubilidade de 16,8%. Este resultado difere do presente estudo, tendo em vista que a incorporação de 30% de acerola (p/p), resultou em uma solubilidade de 29%. A espessura dos biofilmes no trabalho apresentado por Farias et al. [24], também foi menor, fato que pode explicar essa diferença, já que segundo Vicentini [25], quanto maior a espessura dos biofilmes, menor sua solubilidade em água.
Microscopia Eletrônica de Varredura (MEV). As Figuras 3 e 4 apresentam as micrografias dos biofilmes sem adição de acerola (FC), com 20% de polpa de acerola (F20), e com 40% de polpa acerola (F40) para a superfície e seção transversal dos biofilmes, respectivamente.


Através das fotomicrografias de superfície com aumento de 1.000 X (Figura 3), e das fotomicrografias da seção transversal com aumento de 500 X (Figura 4), é possível observar que o biofilme FC (sem adição de acerola) apresentou uma estrutura homogênea, porém, observam–se alguns grânulos de amido não dissolvidos. Além disso, nota–se também, algumas rachaduras em sua superfície. O filme F20, expôs bastante irregularidades e descontinuidade, com muitos grânulos de amido não dissolvidos na superfície, provavelmente ocorreu algum erro experimental referente a temperatura de gelatinização que impediu o rompimento dos grânulos de amido. Já o filme F40, apresentou uma estrutura compacta e densa, praticamente sem irregularidades.
Farias [20], analisou por meio de Microscopia Eletrônica de Varredura (MEV), o comportamento da solução fimogênica preparada com glicerol, amido de mandioca e polpa de acerola, durante aquecimento em diferentes temperaturas, afim de analisar o comportamento dos grânulos de amido ao longo do tempo e constatou por meio da MEV que os grânulos expandiram até o desaparecimento da sua forma inicial após 15–20 minutos, dependendo da presença do agente plastificante. Também constatou que as vitaminas e hidrocolóides de polpa de acerola afetaram a gelatinização do amido.
Aplicação dos biofilmes como revestimento em frutas. A Tabela 4 apresenta o aspecto visual das amostras analisadas com o tempo.
Por meio da análise visual da Tabela 4 é possível observar que as amostras tratadas com biofilme, apresentaram pouca alteração na coloração até o 15° dia, em contrapartida a pera sem revestimento demonstrou aspecto alterado a partir do 5° dia. As amostras tratadas com filme FC e F20 sofreram pequena alteração da cor ao final do experimento, ficando levemente amareladas, enquanto a pera revestida com filme F40 (40% de acerola), manteve sua coloração inalterada. Nas frutas de coloração inicial predominantemente verde, temos uma alteração de cor como indicativo natural do amadurecimento. A degradação da clorofila é a responsável pelo amarelamento típico, que caracteriza o amadurecimento das frutas. Esta degradação pode ser acelerada pela presença de sistemas oxidantes, como o livre contato com O2 atmosférico [26]. Assim, coberturas que atuam como barreira ao O2 também contribuem para redução das alterações de coloração ao longo do tempo [27]). Dessa forma é possível pressupor que a presença de polpa de acerola nos biofilmes, retardou o processo natural de amarelamento e amadurecimento das frutas proporcionalmente a quantidade de polpa de acerola incorporada. Contudo, uma análise do teor de antioxidante presente nos filmes com incorporação de acerola se faz necessário para a confirmação desta afirmação.
A perda de massa da pera sem adição do biofilme ao final do experimento está descrita na Tabela 5.

| Peras | Porcentagem de perda de massa |
| Sem revestimento | 8,2% |
| FC (filme sem adição de acerola) | 5,1% |
| F20 (filme 20% de acerola) | 5,9% |
| F40 (filme 40% de acerola) | 6,4% |
Observa–se através da Tabela 5 que a pera sem revestimento obteve maior perda de massa ao final do experimento. A perda de massa ocorre pela saída na forma de vapor de água para o meio circundante [27], sendo assim os resultados obtidos demonstram que os biofilmes protegeram os frutos ao minimizar a perda de água por transpiração. A incorporação de acerola aos biofilmes acarretou em uma maior perda de massa para as peras revestidas. Galo et al. [28] em seu estudo sobre conservação pós–colheita de mamão ‘Sunrise Solo’ com uso de biofilme de quitosana, relatou uma maior perda de massa nos frutos revestidos com quitosana, e relacionou este resultado com ofato de os frutos tratados com quitosana terem permanecido com a cor verde por mais tempo, pelo retardamento do amadurecimento e, nesta condição, perderem mais massa fresca, decorrente das maiores taxas de respiração e transpiração.
CONCLUSÃO
O presente trabalho teve como objetivo produzir biofilmes de amido de mandioca com incorporação de polpa de acerolae avaliar os efeitos desta adição na matriz filmogênicaA partir dos resultados obtidos, pode–se afirmar que foi possível a síntese de biofilmes de amido adicionados de polpa de acerola através da técnica de casting. De forma geral pode–se concluir que a incorporação de acerola nos biofilmes melhorou suas características, tais como espessura e solubilidade em água. A imagens produzidas pela técnica de MEV, apresentaram uma estrutura densa e uniforme para os biofilmes sem adição de acerola e com 40% de acerola, todavia, no biofilme com 20% de acerola, as imagens produzidas mostraram presença de muitos grânulos de amido não dissolvidos.
Todos os biofilmes aplicados como revestimento mostraram–se eficazes na conservação dos frutos, retardando seu amadurecimento prolongando assim o tempo de prateleira das peras. Sugere–se para trabalhos futuros uma análise do teor de antioxidantes presentes nos biofilmes, afim de confirmar a ação deste na aplicação como revestimento em frutas.
REFERÊNCIAS
- Silva EM “Produção e caracterização de filmes biodegradáveis de amido de pinhão”. Trabalho de Conclusão de Curso (Departamento de Engenharia Química)–Universidade Federal do Rio Grande do Sul, Porto Alegre, 2011
- Santos, Bruna; Coelho, Tania Maria; Nassid Filho N “Produção De Plástico Biodegradável A Base De Amido Modificado”en EPCT –Encontro de Produção Científica e Tecnológica, IX Campo Mourão, PR. Anais. UNESPAR, 2014
- Costa LAS “Desenvolvimento de Bioprodutos a partir da Glicerina Residual do Biodiesel:Goma Xantana em Escala de Biorreator e Filmes Flexíveis Reforçados Com Nanowhiskers”. Tese (Doutorado em Engenharia Química)– Escola Politécnica, Universidade Federal da Bahia, Salvador, Ba, 2014
- Luchese C “Desenvolvimento de embalagens biodegradáveis a partir de amido contendo subprodutos provenientes do processamento de alimentos”. Tese (Doutorado em Engenharia Química) – Escola de Engenharia, Universidade Federal do Rio Grande do Sul, [S. l.], 2018
- Davanço T “Desenvolvimento e caracterização de biofilmes à base de gelatina, triacetina, ácido esteárico ou ácido capróico e surfactantes”.Campinas, 2006. Dissertação (Mestrado em Alimentos e Nutrição). Faculdade de Engenharia de Alimentos, da Universidade Estadual de Campinas.
- Brito GF et al. Biopolímeros, polímeros biodegradáveis e polímero verde.Revista Eletrônica de Materiais e Processos, Campina Grande, Pe, 6(2), 127 (2011)
- Maya NVLP “Produção E Caracterização De Blendas Poliméricas Com Poli (3–Hidroxibutirato)) (Phb) E Amido De Milho Para Produção De Plástico Biodegradável. 2016. Dissertação (mestrado em Engenharia de Alimentos) Universidade Federal de Santa Catarina. Programa de Pós–Graduação em Engenharia de Alimentos. Florianópolis, SC, 2016.
- Mali S, Grossman MV, Yamashita F “Filmes de amido: produção, propriedades e potencial de utilização”. Semina: Ciências, Agrárias, Londrina, 31(1), 137 (2010)
- Follmann HDM “Utilização de Derivados da glicerina na Produção de Plastificantes”. Dissertação para o programa de pós–graduação em Química, Universidade Federal do Paraná, 2009
- Almeida DM et al. “Propriedades físicas, químicas e de barreira em filmes formados por blendas de celulose bacteriana e fécula de batata”, Polímeros, 23(4), 538 (2013)
- Dantas EA et al. “Caracterização e avaliação das propriedades antioxidantes de filmes biodegradáveis incorporados com polpas de frutas tropicais”, Ciência Rural, Santa Maria, 45(1), 142 (2015)
- Nerín C et al. “Behavior of a New Antioxidant Active Film Versus Oxidizable model”, J. Food Engineering, 84, 313 (2008)
- Sousa CMDM. et al. “Caracterização nutricional de compostos antioxidantes em resíduos de polpa de frutas tropicais” Ciência e Agrotecnologia, 59(6), 2248 (2011)
- Melo E, Guerra NB “Ação antioxidante de compostos fenólicos naturalmente presentes em alimentos”, Boletim da Sociedade Brasileira de Ciências Farmacêuticas, 44(2), 193 (2008)
- Fakhouri, Farayde Matta. Bioplasticos flexíveis e biodegradáveis a base de amido e gelatina. 2009. Tese (Doutorado em Engenharia de Alimentos) – Universidade Estadual de Campinas, Faculdade de Engenharia de Alimentos, Campinas, SP.
- Araújo, Grace Kelli Pepineli. Desenvolvimento de filmes biodegradáveis de amido, incorporados com extrato de própolis. 2017. TCC (Engenharia de Alimentos) – Universidade Tecnológica Federal do Paraná, Campo Mourão, PR, 2017
- Silveira, Ricardo Alfonso Dalga da. Produção de filmes Biodegradáveis Maleáveis para evestimentos em mudas de plantas.Trabalho de Conclusão de Curso (Química Bacharelado) Universidade La Salle, Canoas, 2019
- Oliveira LM et al. “Ensaios para avaliação de embalagens plásticas flexíveis”. Campinas: Centro de Tecnologia de Embalagem, CETEA, 219
- Almeida JC, Dezidereio MA, Madolnado RR “Aplicação de Biofilme Comestível a base de Quitosana Dextrina em Peras Armazenadas sob Refrigeração. FOCO: Caderno de Pesquisas, 2017
- Farias MG “Elaboração e caracterização de filmes de amido e polpa de acerola por casting, extrusão termoplástica e termoprensagem”. Tese (Doutorado em Ciência e Tecnologia de Alimentos). Programa de Pós–Graduação em Ciência e Tecnologia de Alimentos, Área de Concentração em Tecnologia de Alimentos. Universidade Federal Rural Do Rio De Janeiro Instituto De Tecnologia, Seropédica, RJ, 2016
- Silva, MCS et al. Avaliação das propriedades físico–químicas e mecânicas de filmes de fécula de mandioca incorporado com cafeína irradiada. Rev Desafios, v. 6, p. 91–99, 2019.
- Shih FF “Edible films from rice protein concentrate and pullulan”, Cereal Chemistry, 73(3), 406 (1996)
- Pessanha KLF “Elaboração e Caracterização Físico–Química de filmes de Amido Acondicionados de Açaí (Euterpe oleracea Mart.) Liofizado”. Dissertação (Mestrado em Ciência e Tecnologia dos Alimentos) Universidade Federal Rural Do Rio De Janeiro. Programa de Pós–Graduação em Ciência e Tecnologia de Alimentos, área de concentração em Tecnologia de Alimentos, 2016.
- Farias MG et al. “O efeito da permeabilidade ao vapor de água, atividade de água, molhabilidade e solubilidade em água em filmes de amido e polpa de acerola” en VI Workshop da Rede de nanotecnologia Aplicada ao Agronegócio, 2012, Fortaleza. Acesso Livre à informação Científica da Embrapa. Embrapa Agroindústria Tropical, 2012
- Vicentini NM “Elaboração e caracterização de filmes comestíveis a base de fécula de mandioca para uso em pós–colheita”. Tese (Doutorado) – Faculdade de Ciências Agronômicas – UNESP, Botucatu – SP, 2003
- Bleinroth EW et al. “Tecnologia pós–colheita de frutas tropicais”. Campinas: ITAL, 1992. (Manual Técnico, 9)
- Assis OBG, Brito D. Revisão: Coberturas comestíveis protetoras em frutas: fundamentos e aplicações, Brazilian J. Food Tecnology, Campinas, SP, 17(2), 87 (2014)
- Galo JQB et al. “Conservação pós–colheita de mamão ‘Sunrise Solo ‘com uso de quitosana”, Rev. Brasileira de Fruticultura, 36(2), 201 (2014)
